Pierwsze Cztery Działy Z Chemii Sprawdzian 1 Gim
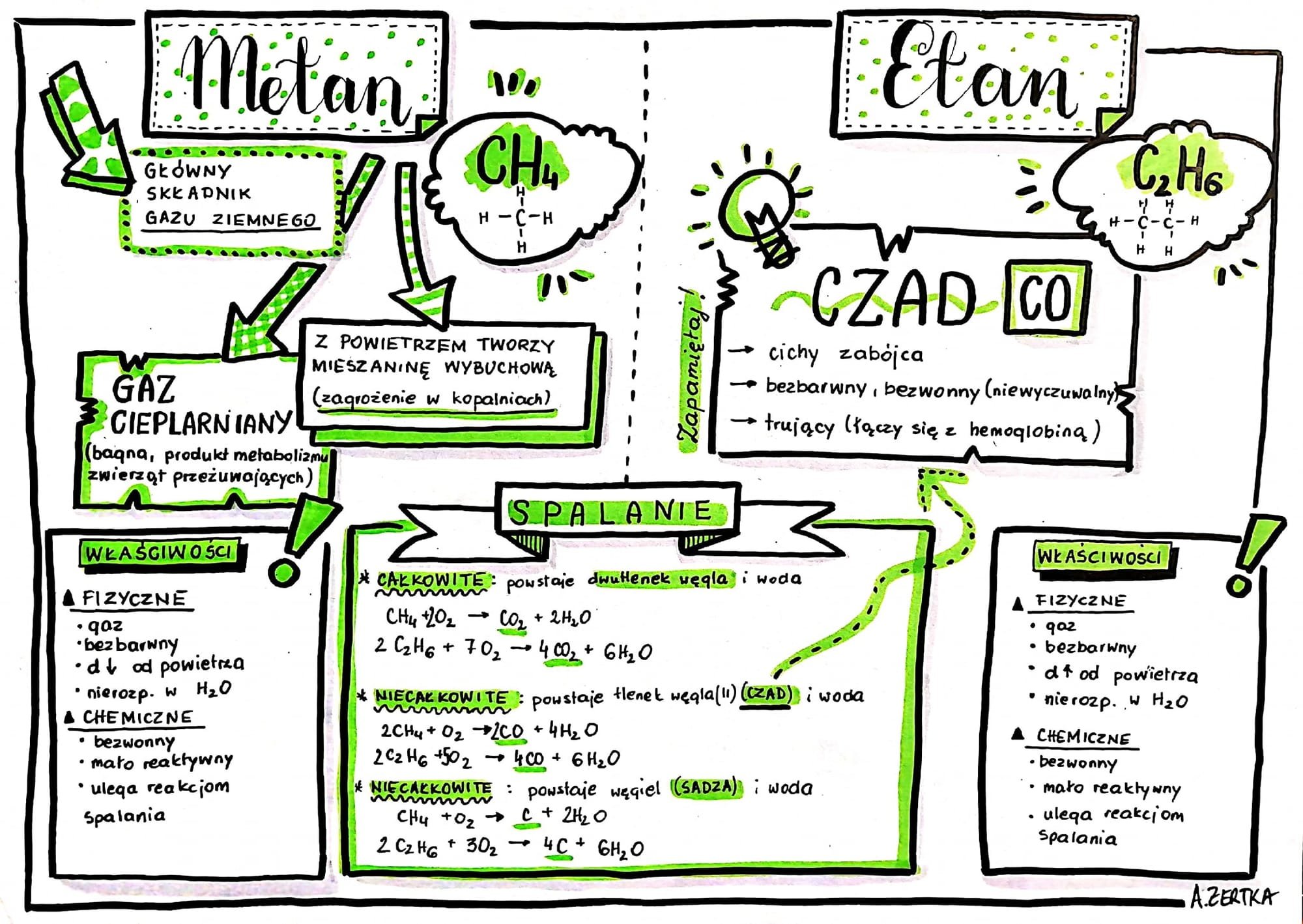
Ok, zaczynamy! Przygotowujesz się do Sprawdzianu 1 z Chemii w Gimnazjum? Świetnie! Skupimy się na Pierwszych Czterech Działach. Rozłożymy je na czynniki pierwsze, żeby wszystko było jasne. No to jazda!
Dział 1: Substancje i ich Właściwości
O co chodzi? Mówimy o materii. Wszystko, co nas otacza, to materia! Dzielimy ją na substancje czyste i mieszaniny.
Substancje czyste: To np. woda destylowana (H₂O) albo czyste złoto (Au). Mają stały skład i określone właściwości (np. temperatura wrzenia).
Mieszaniny: To połączenia różnych substancji. Przykład? Herbata z cukrem! Możemy je rozdzielić na składniki.
Właściwości substancji: To cechy, które pomagają nam je rozpoznać. Np. kolor, zapach, stan skupienia (stały, ciekły, gazowy), rozpuszczalność.
Dział 2: Budowa Atomu
Teraz wchodzimy w mikroskopijny świat! Atom – najmniejsza część pierwiastka, która zachowuje jego właściwości.
Skład atomu:
- Protony (p⁺): Dodatni ładunek, znajdują się w jądrze.
- Neutrony (n⁰): Bez ładunku, również w jądrze.
- Elektrony (e⁻): Ujemny ładunek, krążą wokół jądra.
Liczba atomowa (Z): Mówi, ile jest protonów w jądrze atomu. Określa, jaki to pierwiastek!
Liczba masowa (A): Suma protonów i neutronów w jądrze atomu.
Dział 3: Układ Okresowy Pierwiastków
Układ Okresowy: Tabela, w której uporządkowano pierwiastki według liczby atomowej. To nasz chemiczny "ściągacz"!
Okresy: Poziome rzędy. Numer okresu mówi nam, ile powłok elektronowych ma atom pierwiastka.
Grupy: Pionowe kolumny. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne.
Naucz się rozpoznawać metale, niemetale i gazy szlachetne w układzie okresowym. To podstawa!
Dział 4: Wiązania Chemiczne
Atomy łączą się ze sobą, tworząc cząsteczki lub sieci krystaliczne. Połączenia te nazywamy wiązaniami chemicznymi.
Rodzaje wiązań:
- Wiązanie jonowe: Powstaje między metalem i niemetalem (np. chlorek sodu - NaCl). Atomy oddają lub przyjmują elektrony.
- Wiązanie kowalencyjne: Powstaje między niemetalami (np. woda - H₂O). Atomy uwspólniają elektrony.
Wzory sumaryczne i strukturalne: Uczą nas, jak zapisywać cząsteczki. Wzór sumaryczny podaje liczbę atomów każdego pierwiastka (np. H₂O). Wzór strukturalny pokazuje, jak atomy są ze sobą połączone (kreski oznaczają wiązania).
Pamiętaj, ćwiczenie czyni mistrza! Rozwiązuj zadania, analizuj przykłady i nie bój się pytać! Powodzenia na sprawdzianie!



.jpg)
