Rekacje W Roztworach Wodnych Sprawdzian Z Chemii

Hej Studencie! Przygotowujesz się do sprawdzianu z chemii o reakcjach w roztworach wodnych? Świetnie! Ten przewodnik pomoże Ci uporządkować wiedzę i poczuć się pewniej na teście. Zaczynajmy!
Rozpuszczalność i Roztwory
Rozpuszczalność to maksymalna ilość substancji, która może się rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze. Pamiętaj, że zmienia się ona wraz z temperaturą! Czynniki takie jak polarność rozpuszczalnika i substancji rozpuszczanej mają ogromne znaczenie.
Mówimy o roztworach nienasyconych, gdy można jeszcze rozpuścić więcej substancji. Roztwory nasycone to te, w których rozpuściło się już maksimum, co się da. Roztwory przesycone są wyjątkowe – zawierają więcej substancji rozpuszczonej niż normalnie w danej temperaturze, są niestabilne i łatwo wytrącić nadmiar substancji w postaci osadu.
Stężenie roztworu! To kluczowa sprawa. Możemy je wyrazić na wiele sposobów, na przykład jako stężenie procentowe (masa substancji/masa roztworu * 100%) albo stężenie molowe (liczba moli substancji/objętość roztworu w dm3). Ważne, żeby umieć przeliczać jedno na drugie! Pamiętaj o wzorach i jednostkach!
Reakcje w Roztworach Wodnych
Reakcje w roztworach wodnych często są reakcjami wymiany jonowej. Czyli jony z dwóch różnych związków "wymieniają się miejscami". Żeby reakcja zaszła, musi być spełniony jakiś warunek – na przykład powstanie osadu, gazu albo słabego elektrolitu (np. wody).
Reakcje strąceniowe to takie, w których powstaje osad – nierozpuszczalny związek chemiczny. Musisz znać tablicę rozpuszczalności soli i wodorotlenków! Dzięki niej przewidzisz, czy po zmieszaniu dwóch roztworów powstanie osad, czy nie.
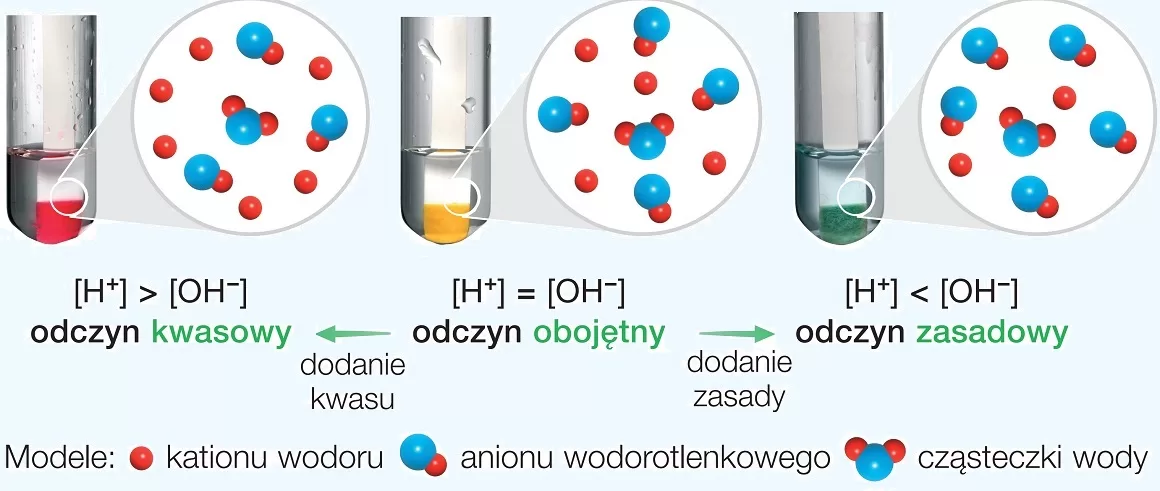
Reakcje kwasów z zasadami to reakcje zobojętniania. Kwas reaguje z zasadą, tworząc sól i wodę. Pamiętaj o mocnych i słabych kwasach i zasadach – to ma wpływ na pH roztworu po reakcji!
Równania Jonowe
Równania jonowe pokazują, które jony biorą udział w reakcji, a które tylko "przyglądają się" (są to tzw. jony obojętne lub jony widzowe). Najpierw zapisujesz równanie cząsteczkowe (normalne równanie reakcji). Potem rozpisujesz wszystkie rozpuszczalne związki na jony (otrzymujesz równanie jonowe pełne). Na koniec skreślasz jony obojętne i zostaje Ci równanie jonowe skrócone, które pokazuje tylko to, co naprawdę reaguje.
Umiejętność pisania równań jonowych jest bardzo ważna! Dzięki nim lepiej rozumiesz mechanizm reakcji i wiesz, co się dzieje na poziomie jonów.
Miareczkowanie
Miareczkowanie to technika analityczna, która pozwala określić stężenie nieznanego roztworu (analitu) poprzez dodawanie do niego roztworu o znanym stężeniu (titranta). Reakcja zachodzi aż do punktu równoważnikowego, kiedy to liczba moli titranta jest stechiometrycznie równoważna liczbie moli analitu.
Do określenia punktu równoważnikowego używa się wskaźników (substancji, które zmieniają kolor w zależności od pH) albo metod instrumentalnych (np. pomiaru pH).
Podsumowanie
Pamiętaj! Dobrze zrozumieć: rozpuszczalność, stężenia roztworów, reakcje strąceniowe i zobojętniania oraz równania jonowe. Miareczkowanie to też istotny temat. Powodzenia na sprawdzianie! Dasz radę!