Sprawdzian Z Chemi 2 Gimnazjum Wodorotlenki Wsip

Sprawdzian z chemii dla klasy 2 gimnazjum, szczególnie ten od WSiP (Wydawnictwa Szkolne i Pedagogiczne), często dotyczy wodorotlenków. Wodorotlenki to związki chemiczne, które warto dobrze zrozumieć. Zrozumienie tych związków pomoże dobrze napisać sprawdzian.
Co to są wodorotlenki?
Wodorotlenki to związki chemiczne zbudowane z kationu metalu i anionu wodorotlenkowego (OH-). Anion wodorotlenkowy nadaje wodorotlenkom charakter zasadowy. Oznacza to, że ich roztwory mają pH powyżej 7. Wodorotlenki są ważne, ponieważ mają szerokie zastosowanie w przemyśle i życiu codziennym.
Wzór ogólny wodorotlenków to Me(OH)n, gdzie Me oznacza metal, a n to wartościowość metalu. Na przykład, wodorotlenek sodu, NaOH, ma jeden jon wodorotlenkowy, ponieważ sód jest jednowartościowy. Z kolei wodorotlenek wapnia, Ca(OH)2, ma dwa jony wodorotlenkowe, ponieważ wapń jest dwuwartościowy.
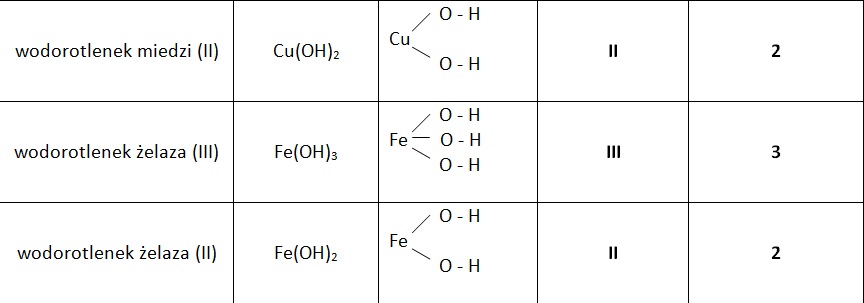
Nazewnictwo wodorotlenków
Nazwy wodorotlenków tworzy się, dodając słowo "wodorotlenek" do nazwy metalu. Jeśli metal ma więcej niż jedną wartościowość, należy ją podać w nawiasie po nazwie metalu cyframi rzymskimi. Przykładowo, wodorotlenek żelaza(II) to Fe(OH)2, a wodorotlenek żelaza(III) to Fe(OH)3. Wartościowość metalu jest równa liczbie grup wodorotlenkowych w cząsteczce.
Zapamiętanie nazw wodorotlenków jest kluczowe. Ucz się nazw i wzorów popularnych wodorotlenków, takich jak wodorotlenek sodu (NaOH), wodorotlenek potasu (KOH), wodorotlenek wapnia (Ca(OH)2) i wodorotlenek glinu (Al(OH)3). Znajomość tych związków znacznie ułatwi rozwiązywanie zadań na sprawdzianie.
Otrzymywanie wodorotlenków
Wodorotlenki metali aktywnych (np. sodu, potasu) otrzymuje się w reakcji metalu z wodą. Reakcja ta jest bardzo energiczna i wydziela się dużo ciepła. Na przykład: 2Na + 2H2O → 2NaOH + H2. Wodorotlenki metali mniej aktywnych (np. miedzi, żelaza) otrzymuje się w reakcji soli danego metalu z wodorotlenkiem metalu aktywnego. Na przykład: CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
Metoda otrzymywania zależy od aktywności metalu. Pamiętaj, że wodorotlenki metali aktywnych powstają bezpośrednio z reakcji z wodą. Natomiast wodorotlenki metali mniej aktywnych wymagają reakcji soli z innym wodorotlenkiem.
Właściwości wodorotlenków
Wodorotlenki metali alkalicznych (np. NaOH, KOH) są substancjami stałymi, higroskopijnymi (pochłaniają wilgoć z powietrza) i dobrze rozpuszczalnymi w wodzie. Ich roztwory są silnie żrące. Wodorotlenki metali bloku d (np. Cu(OH)2, Fe(OH)3) są zazwyczaj nierozpuszczalne w wodzie. Wodorotlenki reagują z kwasami, tworząc sole i wodę. Ta reakcja nazywana jest reakcją zobojętniania.
Wodorotlenki mają charakter zasadowy, co oznacza, że barwią wskaźniki. Lakmus zmienia kolor na niebieski, oranż metylowy na żółty, a fenoloftaleina na malinowy. Wodorotlenki reagują z kwasami dając sole i wodę, neutralizując ich właściwości kwasowe.
Zastosowanie wodorotlenków
Wodorotlenek sodu (NaOH), zwany sodą kaustyczną, jest używany do produkcji mydła, papieru, sztucznego jedwabiu oraz do udrażniania rur kanalizacyjnych. Wodorotlenek wapnia (Ca(OH)2), zwany wapnem gaszonym, stosuje się w budownictwie, rolnictwie do odkwaszania gleby i w procesie oczyszczania ścieków. Wodorotlenek potasu (KOH) jest używany w produkcji mydeł potasowych, które są bardziej miękkie i delikatne niż mydła sodowe. Wodorotlenek magnezu (Mg(OH)2) znajduje zastosowanie w medycynie jako środek zobojętniający kwas żołądkowy.
Zastosowanie wodorotlenków jest bardzo szerokie i obejmuje różne dziedziny życia. Poznanie konkretnych zastosowań wodorotlenków może pomóc lepiej zrozumieć ich znaczenie i powiązania z codziennym życiem.